Le Pr Hugues Patural est pédiatre, Chef de service de Réanimation néonatale et pédiatrique au CHU de Saint-Etienne, responsable du Centre de référence de la mort inattendue du nourrisson. Travaillant dans cet hôpital où il y a environ 3500 naissances par an, et confronté à la problématique des MIN, il a décidé d’en chercher à comprendre les mécanismes. Ses recherches portent particulièrement sur le système nerveux autonome (SNA).
Pourquoi le SNA ?
Dans l’évolution phylogénétique, une structure anatomique commune à toutes les espèces est certainement essentielle pour la survie : c’est le tronc cérébral, qui assure le contrôle des grandes fonctions vitales, par exemple la température, la digestion, la réponse au stress environnemental, et l’adaptation à l’effort.
Le SNA gère les réflexes respiratoires (et la fréquence respiratoire) et les variations fines de la fréquence cardiaque (notamment sous l’influence des barorécepteurs qui analysent les variations de tension artérielle TA). « Autonome », car il fonctionne de façon spontanée, irréfléchie, indépendante de la volonté, sans que nous puissions le commander. Le SNA semble être le marqueur physiologique le plus puissant du bien-être de l’individu, quel que soit son âge.
Mais cela n’est pas aussi simple qu’il y paraît. Cette structure est séparée en deux parties :
- le système nerveux sympathique qui agit comme un accélérateur
- et le système vagal, ou parasympathique, qui agit comme un frein.
Les influences sur respiration, activité cardiaque, dilatation pupillaire… sont en permanence le résultat de l’équilibre de la balance sympathovagale.
On a identifié la localisation anatomique des différentes zones de contrôle, et les ganglions nerveux intermédiaires qui assurent le relai de l’information. L’acétylcholine est le neuromédiateur principal qui induit la réponse.
Pour utiliser une métaphore, on pourrait dire que chaque individu se trouve au volant d’un véhicule avec un frein et un accélérateur, et qu’il va rencontrer différents obstacles auxquels il devra s’adapter. Pour un voyage sans encombre, il faudrait une adaptation fine et permanente, sans aucun défaut d’ajustement… Or, un conducteur jeune sur une voiture neuve va donner des grand coups de frein brusques (hyper-réflectivité vagale du nouveau-né), et un conducteur ou un frein vieillissant aura un défaut de freinage (sujet âgé).
Depuis 1985, on travaille à évaluer cette capacité du système nerveux autonome par des procédés informatisés
- dans des conditions de stabilité (statut autonomique de fond)
- et d’instabilité (apnée, bradycardie) : on juge la qualité d’ajustement et d’adaptation.
variabilité cardiaque
Pour analyser la variabilité cardiaque, les travaux reposent sur l’extraction des intervalles « RR » à partir de l’électrocardiogramme (ECG) permettant d’obtenir une suite d’intervalles entre 2 ondes R successives. Une analyse globale de l’ECG ne permet pas de voir de différences entre 2 intervalles. Mais si ces espaces sont mesurés à la milliseconde (ms) près, par ex 331ms, puis 348 ms…. on obtient une suite de valeurs extrêmement précises, dont on peut calculer la moyenne et la variation autour de la moyenne.
Par exemple (l’espace RR représentant l’inverse de la fréquence cardiaque)
- un RR long = enfant calme qui dort, fréquence cardiaque lente
- un RR plus court = enfant en activité, la fréquence cardiaque s’accélère.
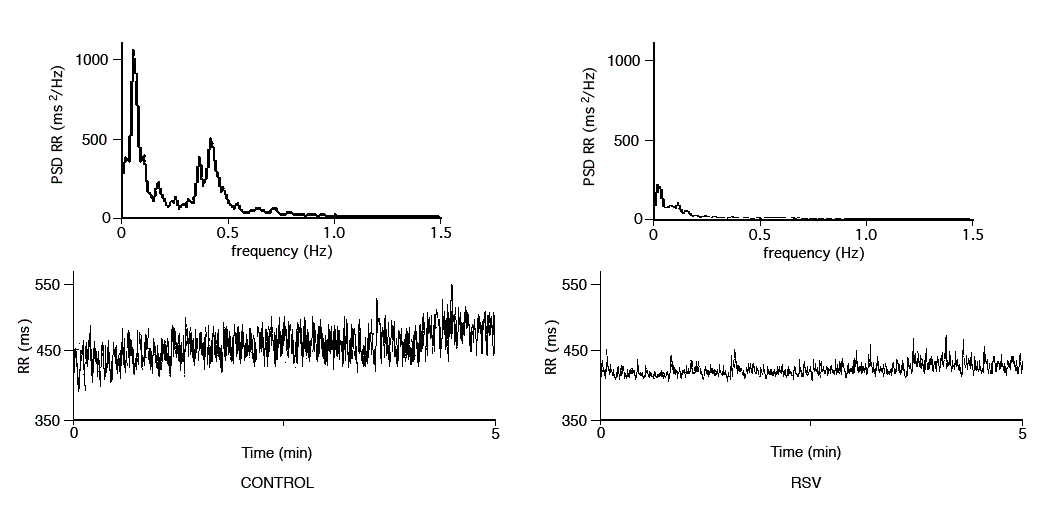
La variabilité de la série RR d’un individu peut être analysée par des méthodes mathématiques de quantification « temporelle » et « fréquentielle ». Ces analyses réalisées sur quelques minutes ou sur 24h permettent de calculer des indices de variabilité dans le temps. Nous obtenons ainsi un signal caractéristique de l’être humain, reproductible pour chaque individu, qui prend la forme de spectres de fréquences : basse fréquence LF (plutôt d’origine sympathique), hautes fréquences HF (caractérisant l’activité parasympathique). Le rapport LF/HF décrit la balance sympathovagale.
L’analyse du baroréflexe spontané, mécanisme de rétrocontrôle rapide de la TA, permet également d’étudier la capacité de l’individu à moduler sa fréquence cardiaque en réponse à des variations de la tension. Cette régulation fine qui dépend de l’état d’équilibre du système nerveux autonome a pour effet de limiter les poussées de Tension Artérielle et protéger ainsi le cerveau.
Tous ces outils de physiologie évaluent la capacité de régulation et l’adaptation de l’individu.
L’activité de base et la réactivité du SNA diminue physiologiquement avec l’âge. Dans les années 90, les premières études de cohorte ont montré une diminution régulière des indices d’activité parasympathique en fonction de l’âge (à 20ans, 40ans, 60 et 80ans) proportionnelle à la survenue de pathologie cardiovasculaire (AVC, crise cardiaque, HTA, Fibrillation auriculaire, dégradation cognitive, etc….). La même analyse réalisée sur des sujets centenaires en bonne forme, objectivait en revanche un « bon » SNA, équivalent de ceux de sujets plus jeunes de 50 ans, argument supplémentaire en faveur du SNA, marqueur prédictif de santé de l’individu. Un suivi longitudinal de cohorte de 1000 sujets âgés de 65 ans a été démarré il y a plus de 10 ans à Saint-Etienne (cohorte PROOF) permettant de montrer des liens étroits entre syndrome d’apnée du sommeil ou pathologie neurocognitive et réactivité du SNA. On retrouve une prédictivité du SNA également chez les personnes ayant eu un infarctus. Dans ce cas, afin d’améliorer le pronostic une « réhabilitation » à l’effort physique (activité physique encadrée 2 à 3 heures, 3 fois par semaine) permet un gain rapide d’activité autonomique.
D’autres études ont été faites sur les liens entre SNA et délai de récupération après anesthésie.
Ainsi, le niveau d’activité du SNA est un facteur très puissant prédictif de l’état de santé, et un facteur de « performance » individuelle. Des recherches sont en cours pour essayer de stimuler artificiellement le SNA, pour améliorer diverses pathologies (obésité, HTA, maladies inflammatoires…).
situations de dysfonctionnement
Applications cliniques en pédiatrie : on peut distinguer deux grands types de situations de dysfonctionnement :
– le cadre des dysautonomies congénitales : lié à des maladies génétiques, très rares, très invalidantes, où la régulation est inopérante (Ex : syndrome d’Allgrove, syndrome d’Ondine, syndrome d’insensibilité congénitale à la douleur et anhidrose…), ou par malformations anatomiques congénitales (ex : syndrome de Rett, maladie de Hirschsprung)
– les situations de dysautonomies acquises :
. au cours de pathologies infectieuses : par exemple en cas de botulisme néonatal où l’enfant développe après intoxication une paralysie musculaire liée à la toxine bactérienne (clostridium botulinum, présent dans le miel), qui bloque également son système de neurotransmission autonomique para et orthosympathique. Ces nourrissons mettent en général trois mois à récupérer un niveau de SNA normal.
. au cours de la bronchiolite due au Virus Respiratoie Syncitial (VRS), chez les enfants de moins de 2 mois, il peut survenir des apnées prolongées par dysfonctionnement de la commande centrale. Leur capacité d’adaptation cardiorespiratoire est effondrée transitoirement puis récupère lentement ce qui les met potentiellement en situation de risque de malaise grave. Les mécanismes de récupération ne sont pas bien compris ni le temps nécessaire pour obtenir une récupération complète à long terme. Cette piste pourrait expliquer l’origine virale de certaines MIN. Ces mêmes constatations de dysautonomie ont été faites après infection au virus de la grippe H1N1.
Des travaux sont en cours pour voir si c’est l’effet du virus lui-même ou celui de l’inflammation secondaire réactionnelle au virus qui est en cause. Les études sur l’effet de la vaccination sont également intéressantes : dans les 24h suivant la vaccination, on observe un défaut transitoire d’adaptation qui récupère vite ensuite, lié à des interactions possibles entre réponse immunitaire (via des interleukines produites) et les centres régulateurs cardiorespiratoires du tronc cérébral.
Chez le nouveau-né à terme : il existe une hyper réactivité vagale (parasympathique) qui est physiologique expliquant les « coups de freins » fréquents observables chez tout nouveau-né et qui ne deviennent pathologiques que si le système accélérateur (sympathique) est pris en défaut. Les obstétriciens utilisent ces indices de variabilité du cœur fœtal comme indicateur de l’état de santé du fœtus pendant le travail. L’étude de la variabilité cardiaque permet ainsi d’appréhender les dysrégulations de la commande cardio-respiratoire, potentiellement en cause dans la survenue des apnées et bradycardies du prématuré, des malaises graves ou de la mort inattendue du nourrisson.
Chez le prématuré : les apnées centrales représentent un témoin de cette immaturité de la commande cardiorespiratoire. L’analyse de la capacité d’autorégulation du SNA chez le prématuré montre que le niveau d’équilibre du SNA peut présenter des défauts de maturation indépendamment de l’âge gestationnel. En comparant à l’approche du terme théorique (40 semaines d’âge « corrigé « ), des enfants prématurés d’âge gestationnel différent (prématurés <27 semaines (500-800g), 28-32 semaines, et 32-37 semaines), le Dr Patural a observé que, quelque soit le degré de la prématurité, il y a un déficit important de capacité de régulation autonomique en comparaison à des enfants nés à terme. Dès la naissance, la maturation du SNA pourrait être bloquée en cas de prématurité, du fait :
- d’un manque éventuel de certains facteurs de croissance neurotrophique d’origine maternelle non suppléés par l’alimentation entérale ou parentérale.
- de stress inhérent à l’hospitalisation (intubation, environnement stressant, gestes douloureux…) qui provoqueraient l’épuisement de l’activité autonomique.
La normalisation des indices de SNA des prématurés comparée à des seuils « normaux » (retrouvés chez des enfants nés à terme) ne s’effectuera parfois que vers 2/3 ans. Les néonatologistes doivent donc être prudent avant de laisser sortir ces bébés à domicile et intégrer la capacité d’ajustement cardiorespiratoire spontanée des enfants. Cet état de dysautonomie prolongée pourrait expliquer un risque de MIN multiplié par 5 à 6 chez les prématurés. Une étude à posteriori d’enfants prématurés, ayant fait des malaises, montre que tous avaient un très faible SNA.
Il est donc souhaitable avant la sortie des enfants à domicile, d’évaluer le « capital autonomique » par des analyses de variabilité de fréquence cardiaque et de l’équilibre sympathovagal, plutôt que de décider d’un retour possible à domicile que sur la persistance ou non de ralentissements cardiaques.
normes de variabilité de la fréquence cardiaque chez le nourrisson
L’équipe du Pr H Patural travaille actuellement sur l’établissement de normes de variabilité de cette fréquence cardiaque chez le nouveau-né et le nourrisson notamment en analysant la cinétique de la maturation du SNA, afin d’avoir une référence solide : la cohorte AuBE (Autonomic Baby Evaluation) est une cohorte de 300 enfants nés à terme ou prématurés, enregistrés à la naissance puis tous les 6 mois jusqu’à deux ans. Les résultats de ces travaux sont attendus d’ici 1 ou 2 ans.
Les techniques d’analyse utilisées sont non invasives : enregistrement de Holter/24 heures et polysomnographie. On étudie sur ces tracés la variabilité cardiaque adaptative en fonction des stades du sommeil. Ces travaux visent également à utiliser l’étude du SNA comme un outil PREDICTIF de survenue de malaise chez le nourrisson. Ainsi, un tracé « normal » pourrait avoir une valeur prédictive importante de bas risque de malaises graves ou de MIN.
Recherche en physiologie animale : Ces travaux de recherche sur un modèle d’agneau prématuré ont été menés par le Pr. Patural au cours d’un stage postdoctoral à Sherbrooke (Québec) dans le laboratoire de physiologie respiratoire dirigé par le Pr JP Praud. Ces travaux ont été soutenus par l’association Naître et Vivre.
L’adaptation cardio-respiratoire au cours d’un stress a été évaluée sur des agneaux nés prématurés. Ces études ont permis de confirmer que ces agneaux prématurés présentent un défaut de l’ajustement cardio-respiratoire et une modification ultra structurale des noyaux cardiorespiratoire du tronc cérébral (prolifération astrocytaire accentuée) par rapport à des agneaux « normaux » contrôles.
Un protocole d’étude a concerné également 3 groupes de 5 agneaux nés à terme : un groupe contrôle, un groupe anesthésié sans acte chirurgical, et un groupe anesthésié avec petite chirurgie, confirmant que les animaux anesthésiés et/ou opérés subissent initialement un stress autonomique avec activation sympathique et vagale. Six jours plus tard, il persiste chez eux une moindre réactivité autonomique par rapport au groupe contrôle. Des études à plus long terme des agneaux prématurés stressés sont nécessaires pour mesurer le temps nécessaire pour récupérer une fonction d’ajustement cardiorespiratoire similaire à celles d’agneaux non prématurés.
modèle de triple risque des MIN
Pour finir, le Pr. Patural rappelle l’aspect multifactoriel (modèle de triple risque) des MIN, où le poids de l’immaturité du contrôle cardio-respiratoire autonomique central (donc d’une probable réponse d’éveil inadaptée), est majeur.
Il insiste cependant sur le fait que la moitié encore des MIN recensées au CHU aurait été évitable grâce à un couchage adapté. Il note aussi des accidents de portage avec des écharpes et insiste sur une meilleure surveillance des nouveau-nés juste après l’accouchement car plusieurs décès ont été observés lorsque le bébé était en position ventrale sur sa mère en post-partum immédiat.
Il insiste enfin sur l’importance de la création de l’observatoire des MIN afin d’obtenir un recensement exhaustif des MIN en France et d’obtenir un maximum d’informations sur les circonstances des décès.
CR rédigé par C. Tran Quang et E. Briand-Huchet et validé par H. Patural.